Está compuesto por partículas puntiformes, o sea, de tamaño despreciable. De esta manera, estas no pueden realizar movimientos de rotación.
La fuerza de interacción eléctrica entre las partículas debe ser nula, o sea, deben estar bien alejadas para que no haya fuerza eléctrica.
Hay interacción solo durante las colisiones, que son perfectamente elásticas; y luego de esta colisión entre dos partículas, no hay pérdida de energía en forma de calor.
Volumen: el volumen de los gases no es fijo porque es siempre igual al volumen del recipiente que los contiene, es decir, el volumen de los gases es variable, adaptándose a la forma del recipiente que los contiene.
Masa: todos los gases poseen masa.
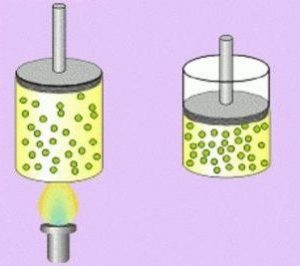
Temperatura: está relacionada con la energía cinética promedio de las partículas. Cuanto mayor es la temperatura, mayor es la energía cinética y mayor es la expansión del gas, y viceversa.
Dilatación y compresión: con el aumento de la temperatura y/o disminución de la presión, el gas se dilata (se expande). Por otro lado, con un disminución de la temperatura y/o aumento de la presión, este sufre una contracción (se comprime).
Fuerzas sobre las paredes del recipiente: las partículas de los gases que están moviéndose chocan contra las paredes del recipiente que los contiene, ejerciendo una presión. Estos choques ocurren de forma perfectamente elástica, lo que significa que no hay variación de energía mecánica total, siempre y cuando el gas esté en equilibrio con el medio externo, o sea, la temperatura del gas y la del medio externo no pueden ser diferentes.
Un aumento en la temperatura hace que las partículas se muevan con mayor velocidad, lo que resulta también en un aumento de la presión ejercida por el gas. Cuando las partículas chocan, también ocurre de forma elástica, sin pérdida de energía cinética entre ellas.
Difusión: las partículas de los gases se difunden en otros gases, o sea, se esparcen, se mueven espontáneamente en otros medios gaseosos.
Densidad: los gases presentan baja densidad porque, en comparación con los líquidos y sólidos, la misma masa ocupa un volumen mucho mayor.
Fuerzas de atracción intermolecular: el gas ideal no interactúa con otros gases. Es importante recordar que este es el comportamiento de los gases ideales, y no de los gases reales.
Por ejemplo, los gases reales interactúan unos con otros. A pesar de eso, los gases reales en determinadas condiciones (bajas presiones y altas temperaturas) poseen un comportamiento muy próximo al ideal.