Gases Ideales
martes, 28 de agosto de 2018
jueves, 10 de mayo de 2018
Ejercicios de la ley de los gases ideales
- Ejercicio 1: calcular el volumen de 6,4 moles de un gas a 210ºC sometido a 3 atmósferas de presión. Solución:
- Estamos relacionando moles de gas, presión, temperatura y volumen por lo que debemos emplear la ecuaciónP · V = n · R · T
- Pasamos la temperatura a Kelvin: 210ºC = (210 + 273) ºK = 483ºK
- V = n · R · T / P = 6,4 moles · 0,0821 · 483ºK / 3 atm. = 84,56 litros
- Ejercicio 2: calcular el número de moles de un gas que tiene un volumen de 350 ml a 2,3 atmósferas de presión y 100ºC. Solución:
- Estamos relacionando moles de gas, presión, temperatura y volumen por lo que debemos emplear la ecuaciónP · V = n · R · T
- Pasamos la temperatura a Kelvin: 100ºC = (100+ 273) ºK = 373ºK
- n = (P · V) / (R · T) = (2,3 atm. · 0,35 l.) / (0,0821 · 373ºK) = 0,0263 moles
Ecuacion general de los gases ideales
Ecuación general de los gases ideales. Partiendo de la ecuación de estado: ... Para una misma masa gaseosa (por tanto, el número de moles «n» es constante), podemos afirmar que existe una constante directamente proporcional a la presión y volumen del gas, e inversamente proporcional a su temperatura.
Formulas de los gases ideales
- Ley de Avogadro: V1 / n1 = V2 / n2
- Ley de Boyle: P1 · V1 = P2 · V2
- Ley de Gay - Lussac: P1 / T1 = P2 / T2
- Ley de Charles: V1 / T1 = V2 / T2
- Ley de los Gases Ideales: P · V = n · R · T
- Ley General de los Gases: P1·V1 / T1 = P2·V2 / T2
- Ley de Graham: v1 / v2 = (M2 / M1)-1/2
- Ley de Dalton: PTotal = p1+p2+...+pn
- Ley de Henry: p = kH · c

Conclusion de los gases ideales
La ley de Boyle establece que el volumen de una determinada cantidad de gas ideal, cuando la temperatura y cantidad de sustancia se mantiene constante, es inversamente proporcional a la presión que ejerce sobre el gas.
La ley de Charles establece que a presión constante y cuando la cantidad de sustancia es constante, el volumen de una masa de gas varía directamente con la temperatura absoluta.
La ley de Gay-Lussac relaciona la variación de la presión con la temperatura cuando se mantienen constantes el volumen y la cantidad de sustancia.
Introduccion de los gases ideales
Los gases son moléculas o átomos que se mueven constantemente. Entre sus características, podemos destacar el volumen variable, difusibilidad y compresibilidad.
El estudio del comportamiento de los gases resultó en una relación entre las variables: temperatura, presión, volumen y número de moles del gas. Esa relación matemática se la conoce como la Ley de los Gases Ideales. La mayoría de los gases reales se comporta de acuerdo con esta ley. Solo en pocas situaciones, como cerca de una transición de fase o temperaturas muy bajas, esta ley no se cumple.
La ley de los gases ideales permite determinar el valor de una de las variables de estado de un gas si se conocen las otras tres. Así, cuando el número de moles de un gas permanece constante, la Ley de los Gases Ideales es expresada por la siguiente ecuación:
P.V=n.R.T
Donde P es la presión; V es el volumen; n es el número de moles, R es la constante de los gases y T es la temperatura. Un gas se dice ideal cuando cumple la Ley de los Gases Ideales. Esta ley es la combinación de las Leyes de Boyle, de Charles y de la Ley de Gay-Lussac y Avogadro.
Caracteristicas de los gases ideales
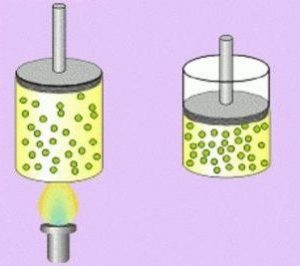
Está compuesto por partículas puntiformes, o sea, de tamaño despreciable. De esta manera, estas no pueden realizar movimientos de rotación.
La fuerza de interacción eléctrica entre las partículas debe ser nula, o sea, deben estar bien alejadas para que no haya fuerza eléctrica.
Hay interacción solo durante las colisiones, que son perfectamente elásticas; y luego de esta colisión entre dos partículas, no hay pérdida de energía en forma de calor.
Volumen: el volumen de los gases no es fijo porque es siempre igual al volumen del recipiente que los contiene, es decir, el volumen de los gases es variable, adaptándose a la forma del recipiente que los contiene.
Masa: todos los gases poseen masa.
Temperatura: está relacionada con la energía cinética promedio de las partículas. Cuanto mayor es la temperatura, mayor es la energía cinética y mayor es la expansión del gas, y viceversa.
Dilatación y compresión: con el aumento de la temperatura y/o disminución de la presión, el gas se dilata (se expande). Por otro lado, con un disminución de la temperatura y/o aumento de la presión, este sufre una contracción (se comprime).
Fuerzas sobre las paredes del recipiente: las partículas de los gases que están moviéndose chocan contra las paredes del recipiente que los contiene, ejerciendo una presión. Estos choques ocurren de forma perfectamente elástica, lo que significa que no hay variación de energía mecánica total, siempre y cuando el gas esté en equilibrio con el medio externo, o sea, la temperatura del gas y la del medio externo no pueden ser diferentes.
Un aumento en la temperatura hace que las partículas se muevan con mayor velocidad, lo que resulta también en un aumento de la presión ejercida por el gas. Cuando las partículas chocan, también ocurre de forma elástica, sin pérdida de energía cinética entre ellas.
Difusión: las partículas de los gases se difunden en otros gases, o sea, se esparcen, se mueven espontáneamente en otros medios gaseosos.
Densidad: los gases presentan baja densidad porque, en comparación con los líquidos y sólidos, la misma masa ocupa un volumen mucho mayor.
Fuerzas de atracción intermolecular: el gas ideal no interactúa con otros gases. Es importante recordar que este es el comportamiento de los gases ideales, y no de los gases reales.
Por ejemplo, los gases reales interactúan unos con otros. A pesar de eso, los gases reales en determinadas condiciones (bajas presiones y altas temperaturas) poseen un comportamiento muy próximo al ideal.
Suscribirse a:
Entradas (Atom)
Explicación del tema
https://www.youtube.com/watch?v=ejYKM1YqY8g
-
Ejercicio 1 : calcular el volumen de 6,4 moles de un gas a 210ºC sometido a 3 atmósferas de presión. Solución : Estamos relacionan...
-
La ley de Boyle establece que el volumen de una determinada cantidad de gas ideal, cuando la temperatura y cantidad de sustancia se mantien...
-
La ley de los gases ideales es la ecuación de estado del gas ideal, un gas hipotético formado por partículas puntuales sin atracció...
